La microscopie confocale
Auteurs : Maura Francis, Cory Boone, Jaclyn Wycoff
La microscopie confocale est un type de microscopie à fluorescence qui utilise un laser pour exciter la fluorescence des fluorophores utilisés pour marquer différents sous-ensembles d'un spécimen. Les microscopes à fluorescence sont utilisés pour l'imagerie des cellules et des tissus qui ont été marqués par fluorescence.1 La microscopie confocale se distingue de la microscopie à épifluorescence conventionnelle par sa résolution accrue lors de l'imagerie de spécimens épais, l'élimination de l'éblouissement hors foyer dû au filtrage spatial et la réduction des dommages causés à l'échantillon par la lumière, connus sous le nom de phototoxicité.
Au lieu d'utiliser une source incohérente de lampe au tungstène ou au mercure comme les microscopes classiques, les microscopes confocaux utilisent un laser pour éclairer l'échantillon.1 Le système recueille ensuite des images sur des plans situés à différentes profondeurs dans l'échantillon, appelés sections optiques, en balayant le laser à différentes positions de mise au point.1 Les sections optiques permettent d'imager des spécimens vivants car il n'est pas nécessaire de sectionner physiquement l'échantillon. L'éclairage de sections plus petites permet également aux spécimens de rester viables plus longtemps en réduisant considérablement les effets de la phototoxicité. La quantité de lumière que les techniques conventionnelles utilisent pour l'éclairage ne permet pas de garantir la vitalité du spécimen imagé, ce qui est indispensable lors de la capture d'événements biologiques.1
Apparence de l'image
Comparées aux images capturées par un microscope à fluorescence classique, les images provenant d'un système de microscope confocal présentent une augmentation marginale de la résolution axiale et latérale, mais le filtrage spatial par le sténopé du système bloque la fluorescence hors foyer pour une image beaucoup plus détaillée (Figure 1).2 Le contraste de l'image est amélioré par rapport aux méthodes traditionnelles en raison d'une réduction du bruit de fond et d'un meilleur rapport signal/bruit. Lors de l'utilisation des techniques conventionnelles, la fluorescence émise par les parties adjacentes de l'échantillon interfère avec le plan d'image et obscurcit le foyer.1 Ceci est problématique car il n'y a aucun moyen de différencier la fluorescence qui ne contribue pas au plan focal imagé, ce qui est particulièrement évident dans les échantillons dont l'épaisseur est supérieure à deux micromètres.1 En utilisant des techniques de filtrage spatial, les microscopes confocaux sont capables d'éliminer ce problème en bloquant toute lumière hors foyer qui obscurcirait l'image.2 La microscopie confocale et la microscopie multiphotonique ont une résolution similaire dans les axes x et y, mais la microscopie multiphotonique a une résolution supérieure dans l'axe z, ou profondeur. Par rapport à la microscopie multiphotonique, la microscopie confocale n'utilise qu'un seul photon pour exciter les colorants fluorescents, ce qui peut entraîner une plus grande dispersion de la lumière dans l'image et l'impossibilité d'obtenir une image aussi profonde dans un échantillon. Les techniques confocales utilisent généralement la lumière du spectre visible, qui a également tendance à se diffuser et à s'absorber davantage dans les tissus biologiques que les longueurs d'onde plus importantes, ce qui peut limiter la profondeur de pénétration possible dans un échantillon. Cependant, la technique confocale s'est toujours avérée avoir une meilleure résolution que les techniques traditionnelles à champ large, ce qui permet de la considérer comme un pont entre les méthodes classiques à champ large et les techniques plus avancées de super-résolution. La microscopie confocale est très bien adaptée à l'imagerie des cultures cellulaires en 2D, tandis que la microscopie multiphotonique et la microscopie à nappe de lumière offrent des avantages pour l'imagerie des échantillons en 3D.
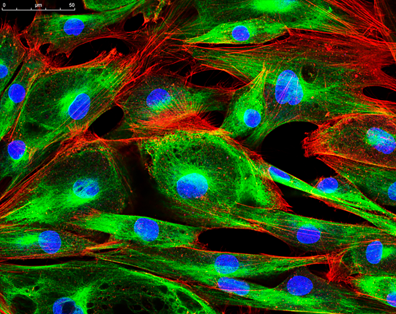
Figure 1 : Une image de protoplastes capturée à l'aide de la microscopie confocale (à gauche) qui est plus finement focalisée qu'une image de microsphères de taille similaire capturée à l'aide de la microscopie conventionnelle à épifluorescence.
Détails techniques
La figure 2 illustre la disposition typique d'un microscope confocal dans lequel on trouve quatre composants clés :
- Source d'excitation laser : émet un faisceau laser dans le système pour se concentrer sur l'échantillon.
- Filtres dichroïques à fluorescence : ils réfléchissent la lumière d'excitation sur l'échantillon et transmettent la fluorescence secondaire, émise par l'échantillon, au système de détection.
- Sténopé : composant essentiel des assemblages confocaux, il agit comme un filtre spatial. Il empêche toute lumière qui n'est pas confocale au plan focal de l'objectif d'interférer avec l'image.2
- Moteurs pas à pas : permet au faisceau laser de se déplacer de manière incrémentielle sur l'échantillon, en obtenant des balayages x et y collectés le long de l'axe z. La collecte des données tridimensionnelles est ainsi automatisée, ce qui permet de créer facilement une image 3D.2
- Objectif : un objectif à haute ouverture numérique (NA) est généralement utilisé pour obtenir de hautes résolutions. Les modèles à immersion dans l'eau ou dans l'huile sont souvent utilisés pour ajuster le décalage de l'indice de réfraction entre le milieu aqueux dans lequel sont conservés de nombreux échantillons vivants. De longues distances de travail sont nécessaires pour les échantillons épais et l'imagerie 3D/sectionnement optique.

Figure 2 : Schéma d'un système de microscopie confocale typique
Comparaison avec d'autres techniques de microscopie3
| Technique | Résolution | Taille de l'échantillon | Coût relatif | Photoblanchiment |
|---|---|---|---|---|
| Microscopie confocale | <µm | µm | $$ | Oui |
| Microscopie multiphotonique | <µm | mm | $$$ | Moins |
| Microscopie en fluorescence à nappe de lumière | µm | >cm | $ | Le moins |
La microscopie confocale chez Edmund Optics®
Edmund Optics® fournit une large gamme de composants optiques pour les applications de microscopie confocale à fluorescence, notamment des filtres, des objectifs, des systèmes laser et des sténopés.

 Ensemble de Filtres de Fluorescence
Ensemble de Filtres de Fluorescence
- Filtres dichroïques, d’excitation, d’émission pour l’imagerie par fluorescence
- Transmission >93% et blocage OD 6 pour une luminosité et un contraste maximum
- Traitements durs par pulvérisation sur un seul substrat
ACHETEZ DÈS MAINTENANT

 Ensembles de Cubes de Filtres de Fluorescence Prémontés
Ensembles de Cubes de Filtres de Fluorescence Prémontés
- Garantissent un alignement exact des jeux de filtres
- Faciles à adapter sur des microscopes ordinaires
- Disponibles pour une variété de longueurs d'onde
ACHETEZ DÈS MAINTENANT

 Filtres Passe-Bande de Fluorescence
Filtres Passe-Bande de Fluorescence
- Longueurs d'onde communes pour les fluorophores populaires
- Filtres d’excitation et d’émission disponibles
- Transmission >93%
- Blocage >OD6, <3% du bord de la bande
ACHETEZ DÈS MAINTENANT

 Filtres Dichroïques de Fluorescence Haute Performance
Filtres Dichroïques de Fluorescence Haute Performance
- Amélioration de la planéité, du front d’onde transmis et de la qualité de surface
- Parfaits pour la microscopie à fluorescence ou les applications d’imagerie à grossissement élevé
- Longueurs d’onde de coupure des filtres dichroïques à fluorescence et passe-haut très courantes
ACHETEZ DÈS MAINTENANT

Objectifs Olympus à Immersion dans l'Eau
- Objectifs à immersion dans l'eau avec des plages de grossissement de 10 à 40X
- Affiche des images plates à partir de facteurs de transmission élevés jusqu'à la région du spectre de l’infrarouge proche
- Idéaux pour l'imagerie par fluorescence des tissus et des échantillons, tels que les tissus cérébraux
ACHETEZ DÈS MAINTENANT

Objectifs Apochromatiques Étendus Olympus X-Line
- Grandes ouvertures numériques (NA) jusqu’à 1,45
- Correction d'aberration chromatique de 400 à 1000 nm
- Planéité d'image uniforme sur de grands champs de vision
ACHETEZ DÈS MAINTENANT

Objectifs Mitutoyo Corrigés à l’Infini - Longue Distance de Travail
- Longues distances de travail
- Inspection à fond clair
- Design plan-apochromatique de haute qualité
- Image plane le long du champ de vision
ACHETEZ DÈS MAINTENANT

Systèmes de Laser Haute Performance OBIS™ LX/LS de Coherent®
- Conception compacte identique pour toutes les options de longueur d'onde
- Électronique à commande intégrée avec modulation analogique et numérique
- Faisceau circulaire avec qualité de faisceau supérieure
ACHETEZ DÈS MAINTENANT

Systèmes de Laser Haute Performance OBIS™ LX/ LS (fibre amorce) de Coherent®
- Lasers OBIS™ LX/LS haute performance avec capacité ajoutée de fibre optique
- La fibre optique fixée en permanence au laser prolonge la durée de vie avec une puissance garantie
- Fibre à maintien de polarisation monomode avec un connecteur FC/APC fournissant un faisceau laser de haute qualité et à faible bruit.
ACHETEZ DÈS MAINTENANT

Sténopés de Précision
- Disponibles en monture d’ouverture pour un support mécanique sécurisé
- Tailles des sténopés de 1 à 1000 µm
- Ouvertures à haute puissance disponibles
ACHETEZ DÈS MAINTENANT

Sténopés Noircis Acktar
- Faible réflexion de l’UVE au SWIR
- Traitement noirci absorbant 99% de la lumière
- Taille d'ouverture comprise entre 20 et 1000 μm
- Versions montées et non montées disponibles
ACHETEZ DÈS MAINTENANT
Références
- Paddock, Stephen W., et al. "Introductory Confocal Concepts" Nikon, https://www.microscopyu.com/techniques/confocal/introductory-confocal-concepts.
- Fellers, Thomas J., and Michael W. Davidson. “Introduction to Confocal Microscopy.” Olympus Scientific Solutions Americas Corp., https://www.olympus-lifescience.com/ru/microscope-resource/primer/techniques/confocal/confocalintro/.
- Santi, P. A. (2011). Light Sheet Fluorescence Microscopy. J Histochem Cytochem, 59(2), 129-138. doi: 10,1369/0,022,155,410,394,857.
Ressources supplémentaires
- Brightfield Illumination Microscopy
- Darkfield Illumination Microscopy
- La microscopie multiphotonique
- Differential Interference Contrast Microscopy
- Fluorescence Microscopy
- La microscopie à nappe de lumière
- Phase Contrast Microscopy
- Configurations de l'objectif du microscope vidéo numérique
- Comprendre les microscopes et objectifs

























ou consulter les numéros d’autres pays
facile à utiliser
entrer les numéros de stock pour commencer
Copyright 2023 | Edmund Optics, Ltd Unit 1, Opus Avenue, Nether Poppleton, York, YO26 6BL, UK
POLITIQUE DE CONFIDENTIALITÉ | POLITIQUE DE COOKIES | CONDITIONS GÉNÈRALES | CONDITIONS GÉNÈRALES B2C | MENTIONS LÉGALES | ACCESSIBILITÉ
L'entreprise Edmund Optics GmbH en Allemagne agit comme un mandataire d'Edmund Optics BV aux Pays-Bas.
Le titulaire du contrat est Edmund Optics BV aux Pays-Bas.
The FUTURE Depends On Optics®