La microscopie à nappe de lumière
Auteurs : Maura Francis, Cory Boone, Jaclyn Wycoff
La microscopie en fluorescence à nappe de lumière (LSFM), également appelée microscopie à éclairage plan sélectif (SPIM), est une méthode de microscopie à fluorescence de moyenne à haute résolution qui capture des images à grande vitesse. Elle est bien adaptée à l'imagerie tridimensionnelle d'échantillons biologiques à des profondeurs multiples, ce que l'on appelle le sectionnement optique. Une nappe de lumière laser est focalisée dans un plan bidimensionnel, généralement à l'aide d'une lentille cylindrique, pour n'éclairer qu'une fine tranche de l'échantillon et exciter la fluorescence, ce qui réduit la phototoxicité et les dommages à l'échantillon (Figure 1).

Figure 1 : La microscopie en fluorescence à nappe de lumière (LSFM) excite la fluorescence dans des échantillons tridimensionnels à travers un plan bidimensionnel qui couvre un volume plus petit que l'excitation dans les techniques de fluorescence conventionnelles. Cela réduit la phototoxicité et les dommages aux échantillons biologiques sensibles.1
Une région beaucoup plus grande de l'échantillon est éclairée en microscopie à épifluorescence classique. L'éclairage d'excitation traverse l'échantillon dans la direction axiale (z) et excite la fluorescence à la fois dans le plan focal et en dehors de celui-ci.1 Cette fluorescence hors foyer rend plus difficile la mesure précise du signal au foyer.
Comment cela fonctionne
Dans les microscopes à épifluorescence ou confocaux, l'éclairage d'excitation et l'objectif d'imagerie partagent un trajet lumineux commun. En LSFM, la source d'éclairage est séparée et généralement perpendiculaire au chemin de détection dans le système.2 Les différentes configurations LSFM peuvent généralement être divisées en systèmes avec des nappes de lumière planes ou balayées.1 Ce guide traite principalement de la configuration à nappe de lumière plane, dans laquelle une nappe de lumière laser plane est créée par la combinaison d'une lentille cylindrique associée à un faisceau gaussien.2 En aplatissant le faisceau traversant le système, qui est par ailleurs circulaire, la lentille cylindrique crée une bande de lumière parallèle au plan focal.2 Comme un plan entier est capturé, le temps d'imagerie est considérablement réduit par rapport aux techniques conventionnelles où seul un point de lumière est focalisé. C'est l'un des inconvénients majeurs de l'approche de la microscopie multiphotonique, où les échantillons peuvent devoir être imagés pendant des heures, contre quelques minutes avec la LSFM.2 Cependant, la manipulation et le traitement des données deviennent rapidement un problème avec la quantité de données acquises.1 La LSFM peut être mise en œuvre avec la microscopie multiphotonique pour améliorer les profondeurs d'imagerie dans le spécimen et améliorer la résolution spatiale.3 Un autre inconvénient de la LSFM est la complexité de l'alignement avec l'adoption de plus de deux objectifs.
La LSFM est principalement utilisée pour imager des échantillons biologiques et peut être réalisée in vivo. Des spécimens relativement grands (plusieurs mm) et optiquement transparents peuvent être imagés à l'aide de cette technique grâce à la pénétration de la lumière de la nappe laser. Alors que d'autres techniques peuvent être plus intéressantes pour obtenir des images à des résolutions plus élevées, la LSFM offre l'avantage d'une faible photodégradation de l'échantillon. Dans les applications cellulaires où le mouvement et les processus dynamiques sont présents, la LSFM offre la possibilité d'imager rapidement de grandes zones.3 Cette technique peut être utilisée pour visualiser des observations en accéléré dans des volumes tridimensionnels sur de longues périodes de temps.4 La stabilité optique doit être maintenue pour obtenir de bons résultats de vue en accéléré. Les fluctuations de température peuvent entraîner des déplacements de l'échantillon, et les prises de vue en accéléré ne sont pas bien adaptées à l'imagerie d'échantillons vivants, car ils peuvent se déplacer pendant la capture.
Les principaux avantages de la microscopie à nappe de lumière peuvent tous être attribués à son éclairage plan. Avec les techniques de microscopie classiques, il est difficile de préserver l'intensité de la lumière à travers l'intégralité d'échantillons épais. Lors de l'imagerie de spécimens épais, il est normal d'observer une chute de lumière, l'intensité lumineuse diminuant le long du plan focal. Cela peut être encore plus apparent dans les spécimens présentant des caractéristiques opaques qui peuvent bloquer la lumière. Lorsque cela se produit, il y a un effet de rayure qui donne l'impression que l'élément a une ombre, ainsi qu'une perte de résolution.1 La LSFM et la mise en œuvre de deux sources d'éclairage de part et d'autre de l'échantillon permettent de compenser l'affaiblissement de la lumière.2
Apparence de l'image
La Figure 2, ci-dessous, montre comment la différence de méthodes d'éclairage entre la microscopie à fluoroscence conventionnelle et la LSFM peut modifier l'apparence des images.
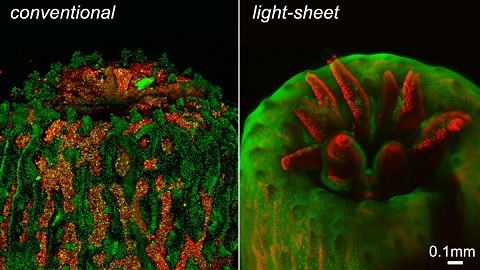
Figure 2 : Un polype imagé à l'aide d'un microscope à fluorescence classique contient un bruit de fond important dû à la fluorescence hors du plan focal. L'éclairage intense provoque également la rétraction du polype. En revanche, la LSFM élimine cette fluorescence hors-foyer et le polype émerge complètement sous l'éclairage plus doux d'un système LSFM développé par l'Université d'Essex.1, 4
Figure 2 : Un polype imagé à l'aide d'un microscope à fluorescence classique contient un bruit de fond important dû à la fluorescence hors du plan focal. L'éclairage intense provoque également la rétraction du polype. En revanche, la LSFM élimine cette fluorescence hors-foyer et le polype émerge complètement sous l'éclairage plus doux d'un système LSFM développé par l'Université d'Essex.1, 4
Il y a plusieurs facteurs de la LSFM qui jouent un rôle dans l'amélioration de la qualité de l'image. L'échantillon est déplacé et tourné pour obtenir des images de plusieurs tranches fines parallèles au plan focal, ou la nappe de lumière elle-même est balayée sur l'échantillon.2 En capturant la même partie de l'échantillon sous différents angles de vue, la résolution peut être augmentée par la fusion de ces images séparées. L'ouverture numérique (NA) des objectifs d'éclairage influence également la résolution.2 La NA détermine l'angle selon lequel l'objectif peut collecter ou émettre de la lumière. Un objectif avec une NA élevée permet d'obtenir une meilleure résolution limitée par la diffraction et entraîne une diminution de la zone visible de l'échantillon, appelée champ de vision (FOV). Cependant, un petit champ de vision n'est pas idéal pour l'imagerie de spécimens épais, car il faut plus de temps pour imager une zone donnée. La LSFM a la capacité d'imager des spécimens de plusieurs dizaines de millimètres d'épaisseur sans dégradation de l'image due à la chute de l'éclairage, soit une épaisseur d'environ 9 mm supérieure à celle d'un microscope confocal typique.1 Ceci est important pour l'imagerie de spécimens épais avec la microscopie à fluorescence en raison de la fluorescence secondaire qui se produit en dehors de la région focale, ce qui peut obscurcir l'image. La LSFM ne rencontre pas ce problème puisqu'elle n'éclaire que le plan focal et qu'aucun autre excès de fluorescence n'est excité.
Lorsque la technique fait appel à une nappe de lumière créée par un faisceau gaussien avec un waist fin, elle permet d'obtenir une meilleure résolution dans la direction axiale. Cependant, elle diminue la longueur de propagation à travers l'axe d'éclairage. Le champ de vision est donc plus petit. D'autre part, un faisceau gaussien avec un waist épais peut être utilisé, ce qui se traduira par une propagation plus longue, mais qui à son tour diminuera la résolution.4 Cependant, cela peut également conduire à une augmentation des photodommages de l'échantillon.
Détails techniques
Bien qu'il existe de nombreuses variantes de configurations LSFM, la Figure 3 montre une disposition typique du système dans laquelle une source laser est utilisée pour l'éclairage et un miroir de balayage déplace le faisceau laser sur un échantillon stationnaire. Il est possible d'intégrer plusieurs sources laser et détecteurs en utilisant des filtres dichroïques, également appelés miroirs dichroïques, pour combiner les faisceaux.

Figure 3 : Schéma simplifié d'un système LSFM.5
- Source d'excitation laser : émet un faisceau gaussien laser dans le système pour le focaliser sur l'échantillon. Plusieurs lasers peuvent être combinés à l'aide de filtres dichroïques et tous dirigés sur le miroir de balayage.3
- Miroir de balayage : ajuste la position du faisceau laser et détermine l'endroit où il entre en contact avec l'échantillon.
- Expanseur de faisceau : augmente le diamètre du faisceau avant qu'il n'atteigne la lentille cylindrique. Cela permet une mise au point plus serrée dans la dimension étroite de la nappe de lumière.
- Lentille cylindrique : focalise le faisceau dans une dimension de sorte qu'une fine nappe de lumière se forme sur l'échantillon après que le faisceau a traversé l'objectif d'éclairage.
- Objectif(s) d'éclairage : placé(s) perpendiculairement au(x) détecteur(s). Il détermine le champs de vision et la quantité de lumière à laquelle l'échantillon est exposé en fonction de sa NA. On utilise parfois deux objectifs d'éclairage et deux trajets de faisceau laser de part et d'autre de l'échantillon pour minimiser les pertes de lumière.
- Montage de l'échantillon : critique car il détermine essentiellement quelle LSFM mettre en œuvre. Différentes formes de fixation d'un échantillon peuvent être réalisées en l'immobilisant dans un gel, en l'accrochant, en l'immergeant dans un milieu ou en le plaçant sur une lamelle.2
- Objectif(s) détecteur(s) : recueillent la lumière qui se propage hors du système pour qu'elle soit analysée. On préfère généralement des NA élevées pour améliorer la résolution. Lorsque l'échantillon est immergé dans un liquide, on utilise souvent des objectifs à immersion dans l'eau
- Filtres : les filtres coupe-bande, passe-haut ou passe-bande éliminent l'éclairage laser qui peut être diffusé par l'échantillon.
- Lentille tube : forme une image sur le détecteur. Lorsque l'on utilise plusieurs détecteurs, les filtres dichroïques peuvent séparer les différentes longueurs d'onde après l'objectif du détecteur. Chaque longueur d'onde aurait alors sa propre trajectoire de faisceau, son filtre coupe-bande, sa lentille tube et son détecteur.
- Détecteur : capture des images.
- Platine de translation (xyzθ) : permet le déplacement dans les directions x-y-z avec rotation. Cela permet de capturer des images sous différents angles de vue qui sont ensuite fusionnées pour augmenter la résolution.
Les applications de la microscopie en fluorescence à nappe de lumière
Application 1 : Suivi de l'embryogenèse (développement de l'embryon)
L'un des cas d'utilisation les plus courants de la LSFM est le suivi du développement des embryons chez les humains et les animaux, connu sous le nom d'embryogenèse.1 Les embryons sont marqués avec des marqueurs fluorescents qui peuvent être excités par la nappe de lumière d'un système LSFM. Cela permet aux scientifiques de suivre la croissance des cellules dans les embryons en développement. La mise en œuvre d’un logiciel permet le suivi automatisé des cellules. Le grand champ de vision et la vitesse élevée de la LSFM la rendent avantageuse pour l'imagerie des embryons et d'autres échantillons vivants de grande taille.
Application 2 : Otolaryngologie (étude des oreilles et de l'audition)
La LSFM a également été une technique instrumentale pour l'otolaryngologie, car elle est bien adaptée à l'imagerie des composants de l'oreille moyenne et interne.1 La LSFM a permis aux chercheurs de générer des modèles 3D des structures de l'oreille plus détaillés que les modèles précédents.
Comparaison avec d'autres techniques de microscopie6
| Technique | Résolution | Taille de l'échantillon | Coût relatif | Photoblanchiment |
|---|---|---|---|---|
| Microscopie confocale | <µm | µm | $$ | Oui |
| La microscopie multiphotonique | <µm | mm | $$$ | Moins |
| Microscopie en fluorescence à nappe de lumière | µm | >cm | $ | Le moins |
La microscopie en fluorescence à nappe de lumière chez Edmund Optics®
Edmund Optics® fournit une large gamme d'optiques pour les applications LSFM, notamment des expanseurs de faisceau, des lentilles cylindriques, des objectifs de microscope et des filtres coupe-bande. Des composants idéaux pour ces systèmes sont ajoutés en permanence pour suivre l'évolution de ce domaine d'application.

 Expanseurs de Faisceau
Expanseurs de Faisceau
- Utilisés pour étendre le faisceau d'excitation après le miroir de balayage
- Large gamme de traitements raie laser et à large bande de 257 nm à 3 µm
- Modèles disponibles avec réglage de la divergence et du grossissement
- Assemblages de haute puissance exempts de problèmes liés aux images fantômes à focalisation interne
ACHETEZ DÈS MAINTENANT

 Lentilles Cylindriques Qualité Laser
Lentilles Cylindriques Qualité Laser
- Concentrent le faisceau d'éclairage dans une dimension pour former la nappe de lumière
- Traitements raie laser et à large bande pour les lasers courants
- Les traitements raie laser offre une réflectivité <0,25%
- Substrats de silice fondue
ACHETEZ DÈS MAINTENANT

Objectifs Olympus à Immersion dans l'Eau
- Gammes de grossissement de 10 à 40X
- Affichent des images plates à partir de facteurs de transmission élevés jusqu'à la région du spectre de l’infrarouge proche
- Idéaux pour l'imagerie par fluorescence des tissus et des échantillons, tels que les tissus cérébraux
ACHETEZ DÈS MAINTENANT

Objectifs Apochromatiques Étendus Olympus X-Line
- Grandes ouvertures numériques (NA) jusqu’à 1,45
- Correction d'aberration chromatique de 400 à 1000 nm
- Planéité d'image uniforme sur de grands champs de vision
ACHETEZ DÈS MAINTENANT

Objectifs Mitutoyo Corrigés à l’Infini - Longue Distance de Travail
- Inspection à fond clair
- Design plan-apochromatique de haute qualité
- Image plane le long du champ de vision
ACHETEZ DÈS MAINTENANT

 Objectifs Réfléchissants
Objectifs Réfléchissants
- Longue distance de travail pour une intégration simple dans des systèmes
- Activement alignées pour une performance optimale
- Bande spectrale ultra-large de 190 nm à 11 μm sans aberration chromatique
- Options limitées par la diffraction avec un front d'onde transmis de λ/14 RMS
ACHETEZ DÈS MAINTENANT

 Filtres Passe-Bande de Fluorescence
Filtres Passe-Bande de Fluorescence
- Longueurs d'onde communes pour les fluorophores populaires
- Filtres d’excitation et d’émission disponibles
- Transmission >93%
- Blocage >OD6, <3% du bord de la bande
- Des Ensembles de Filtres de Fluorescence et des Ensembles de Cubes de Filtres de Fluorescence Prémontés sont également disponibles
ACHETEZ DÈS MAINTENANT

 Filtres dichroïques de fluorescence
Filtres dichroïques de fluorescence
- Idéaux en imagerie par fluorescence ou multi-spectrale
- Transition brutale de la réflexion à la transmission
- Bandes de réflexion et de transmission étendues
- Des Filtres Dichroïques de Fluorescence Haute Performance sont également disponibles
ACHETEZ DÈS MAINTENANT

 Filtres Coupe-Bande
Filtres Coupe-Bande
- Bloquent toute longueur d'onde d'excitation qui pourrait être dispersée de l'échantillon
- Options OD 4,0 et OD 6,0
- Larges gammes de transmission
ACHETEZ DÈS MAINTENANT

Galvanomètres/Scanners Optiques ScannerMAX Saturn
- Ouvertures de miroirs de 3, 5 et 10 mm
- Configurations à axe unique et double axe
- Scanners à haute performance pour les applications d'imagerie et de projection
ACHETEZ DÈS MAINTENANT

Systèmes de Laser Haute Performance OBIS™ LX/LS de Coherent®
- Conception compacte identique pour toutes les options de longueur d'onde
- Électronique à commande intégrée avec modulation analogique et numérique
- Faisceau circulaire avec qualité de faisceau supérieure
- Également disponibles : Systèmes de Laser Haute Performance OBIS™ LX/ LS (fibre amorce) de Coherent®
ACHETEZ DÈS MAINTENANT

Systèmes de Rail Optique à Queue d'Aronde
- Large gamme de longueurs de cavaliers et de trous de montage disponibles
- Conception à profil bas avec mouvement doux et sans à-coups
- Stabilité accrue et précision linéaire < 1mrad
ACHETEZ DÈS MAINTENANT

Tables Optiques
- Tables optiques et platines de laboratoire
- Options impériales et métriques
- Variété d'accessoires de tables optiques et de composants optomécaniques disponibles
ACHETEZ DÈS MAINTENANT
Références
- Allen, J. R. “Light Sheet Fluorescence Microscopy.” Nikon, https://www.microscopyu.com/techniques/light-sheet/light-sheet-fluorescence-microscopy
- Pasche-Drews, M. “Application Note: Light Sheet Microscopy.” Teledyne Photometrics, https://www.photometrics.com/applications/appnotes/light-sheet-microscopy.
- Albert-Smet, I. et al. “Applications of Light Sheet Microscopy in Microdevices.” Front. Neuroant. https://www.frontiersin.org/articles/10.3389/fnana.2019.00001/full
- Laissue, P. P., et al. (2017). Assessing phototoxicity in live fluorescence imaging. Nature Methods, 14(7), 657-661. doi: 10.1038/nmeth.4344.
- Olarte, O. E., et al. (2018). Light-sheet microscopy: a tutorial. Advances in Optics and Photonics, 10(1), 111-179. doi.org/10.1364/AOP.10.000111
- Santi, P. A. (2011). Light Sheet Fluorescence Microscopy. J Histochem Cytochem, 59(2), 129-138. doi: 10,1369/0022155410394857
Ressources supplémentaires
- Brightfield Illumination Microscopy
- Darkfield Illumination Microscopy
- La microscopie confocale
- Differential Interference Contrast Microscopy
- Fluorescence Microscopy
- La microscopie multiphotonique
- Phase Contrast Microscopy
- Configurations de l'objectif du microscope vidéo numérique
- Comprendre les microscopes et objectifs
- À considérer lors de l’utilisation de lentilles cylindriques
- What Are Cylinder Lenses?
- Propagation des faisceaux gaussiens
- Calculateur des faisceaux gaussiens
- Expanseurs de faisceau laser



























ou consulter les numéros d’autres pays
facile à utiliser
entrer les numéros de stock pour commencer
Copyright 2023 | Edmund Optics, Ltd Unit 1, Opus Avenue, Nether Poppleton, York, YO26 6BL, UK
POLITIQUE DE CONFIDENTIALITÉ | POLITIQUE DE COOKIES | CONDITIONS GÉNÈRALES | CONDITIONS GÉNÈRALES B2C | MENTIONS LÉGALES | ACCESSIBILITÉ
L'entreprise Edmund Optics GmbH en Allemagne agit comme un mandataire d'Edmund Optics Ltd au Royaume-Uni. Le titulaire du contrat est Edmund Optics Ltd au Royaume-Uni.